candidum – Computerunterstütztes Enzym-Design
Seit über hundert Jahren nutzt die Industrie Enzyme. Musste sie sich anfangs noch mit natürlichen Enzymen begnügen, gelingt es heute immer besser, maßgeschneiderte Biokatalysatoren mit gewünschten Eigenschaften zu entwerfen. Das Stuttgarter Start-up candidum GmbH verspricht, schneller als bisher zum Ziel zu gelangen – vor allem dank beschleunigtem virtuellem Screening.

Enzyme sind fast ausschließlich Proteine, die sich aus natürlichen Aminosäuren zusammensetzen. Ohne sie wären die meisten biochemischen Reaktionen in lebenden Organismen – von der Verdauung bis hin zum Kopieren der Erbinformation – deutlich langsamer oder erst gar nicht möglich. 1907 wurde erstmals ein industriell verwertetes Enzymprodukt von der Firma Röhm & Haas für das Lederbeizen produziert.
Heute rücken Enzyme zudem in Wasch- und Reinigungsmitteln dem Schmutz zu Leibe. In der Lebensmittelindustrie helfen sie etwa Apfelsäfte zu klären oder Hart- und Weichkäse herzustellen. Tierfutter zugesetzt, sollen sie die Verdauung fördern. Enzyme helfen auch bei der Herstellung von Textilien, Papier, Medikamenten oder Biotreibstoffen.
Evolution im Zeitraffer
Indem Molekularbiologen gezielt die Aminosäuresequenz der Enzyme verändern, lassen sie sich idealerweise an die vorgesehene Arbeitsumgebung anpassen – analog zur natürlichen Evolution, nur eben im Zeitraffer. Auch maßgeschneiderte Biokatalysatoren für nicht-natürliche Reaktionen sind denkbar. Doch mit den bisherigen Verfahren war das aufwendig und nur selten erfolgreich.
Nehmen wir an, ein Waschmittelhersteller will seinem Produkt ein Enzym zusetzen, das auch noch bei Kochwäsche Fettflecken aus Textilien herauslöst. „Ist das Enzym in seiner physiologischen Umgebung auf 30-40 Grad Celsius optimiert, würde es bei 90 Grad denaturieren und seine dreidimensionale Struktur verlieren“, sagt Dr. Sven Benson, Gründer des Enzymentwicklungs-Unternehmens candidum GmbH. Candidum ist das lateinische Wort für „glänzend weiß, strahlend“ – auch wenn die Firma nicht nur Waschmittelenzyme designt.
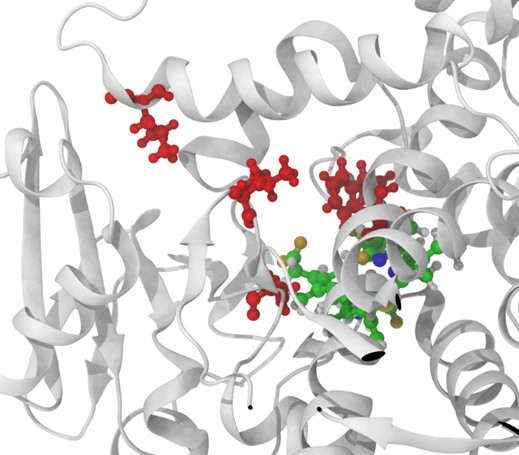
Bislang standen Enzymdesigner vor dem Problem, dass sie meist nicht wussten, an welchen Positionen innerhalb der Aminosäuresequenz sie Mutationen einfügen müssen, um etwa ein Enzym hitzebeständig zu machen. Selbst wenn sie nur fünf der meist 500 bis 1.000 Aminosäuren langen Enzyme austauschen, gäbe es bei 20 möglichen Aminosäuren insgesamt 3,2 Millionen Varianten, die sie im Labor auf Hitzebeständigkeit hin testen müssten. Diese Vielfalt ist sogar mit Hochdurchsatz-Screening-Methoden zeitlich und finanziell kaum zu bewältigen. Die Wissenschaftler des Stuttgarter Start-up testen hingegen nur die 50 bis 100 vielversprechendsten Enzymvarianten im Labor durch. Den größten Teil der Varianten können sie bereits zuvor am Computer als voraussichtlich wenig erfolgreich verwerfen.
Lernen von der Natur
Beim Enzym-Engineering lassen sich die Jungunternehmer auch von der Natur inspirieren, die in Jahrmillionen unendlich viele Enzyme hervorgebracht hat. Um beispielsweise einem fettspaltenden Enzym Hitzestabilität zu verleihen, würden sie am Computer riesige Sequenzdatenbanken bekannter Enzyme nach solchen mit ähnlicher räumlicher Struktur und Funktion durchforsten. Interessant wären in dem Fall die Enzyme, die aus Organismen stammen, welche in heißen Quellen oder Vulkanen leben. Das Ziel ist, durch Vergleich der Aminosäuresequenzen jene konservierten Bereiche zu finden, die nur hitzetolerante Enzyme aufweisen und diese vermutlich hitzestabil machen.
In diesen Bereichen ist es dann sinnvoll, beim Ausgangsenzym Mutationen einzuführen, um es hitzestabil zu machen. Die verbliebene Anzahl möglicher Enzymvarianten ist dennoch riesig. Um sie zu reduzieren und gezielt weiter zu optimieren, kommt als nächstes eine Kernkompetenz von candidum ins Spiel: molekulardynamische Simulationen.
Dabei simulieren die Stuttgarter am Computer, wie sich während der Enzymreaktion einzelne Atome des Enzyms, seines Substrats und des Lösungsmittels aufgrund von gegenseitigen Wechselwirkungen bewegen – in dem Fall bei hohen Temperaturen. So lässt sich schon vor dem Gang ins Labor testen, wie sich ein Aminosäureaustausch auf die dynamische Eigenschaft des Enzyms und damit auf die enzymatische Reaktion auswirken könnte.
Benson hat sich bereits während und nach der Doktorarbeit am Institut für Technische Biochemie der Universität Stuttgart ausgiebig mit molekulardynamischer Simulation von Enzymen beschäftigt. Neben der Doktorarbeit tüftelte der Biologe an Algorithmen, um die Simulation zu beschleunigen.
Virtuelle Enzymtests im Schnelldurchlauf

„Eine zentrale Herausforderung dieser Simulationsmethode war, dass man über Monate hinweg viele Simulationen auf Hochleistungsrechnern durchführen musste, um die Enzym-Substrat-Interaktion ansatzweise durchcharakterisieren zu können“, erinnert sich Benson. Mittlerweile verspricht das Unternehmen auf der Website, dank des entwickelten Simulationsalgorithmus „ein Enzym in 30 Tagen“ zu entwerfen.
Ursprünglich wollte Benson in der akademischen Forschung bleiben. Doch der Konkurrenzkampf Richtung Professur, die knappen Finanzmittel und Vorgaben bei öffentlichen Forschungsprojekten bewogen ihn schließlich dazu, sich selbstständig zu machen. „Man sagt immer, die Forschung ist befreit von allen Zwängen, aber wir haben noch nie freier und zielstrebiger geforscht als seit dem Moment der Selbstständigkeit“, sagt Benson.
2016 gründete der Biologe eine Transfer- und Gründerunternehmung unter dem Dach der TTI – Technologie-Transfer-Initiative GmbH an der Universität Stuttgart. Dafür holte er sich seine Institutskollegen Lenz Lorenz und Philipp Schellenberger, beide ebenfalls Biologen, mit ins Boot. Im Technologiepark der Universität haben die drei Start-up-Gründer die ersten Schritte als Unternehmer gewagt – mit betriebswirtschaftlicher und administrativer Unterstützung seitens der TTI.
Während Lorenz sich als Technikvorstand darum kümmert, die Algorithmen stetig zu optimieren und weiterzuentwickeln, beaufsichtigt Schellenberger als Laborchef die realen Enzymtests im Labor. Im April 2018 folgte die Umwandlung in eine GmbH. Mittlerweile ist das Start-up-Team um zwei weitere Mitarbeiter und mehrere studentische Hilfskräfte angewachsen.
Neuartige Enzyme als Marktlücke
Der Start des jungen Unternehmens war mühsam, erinnert sich Benson: Jede Menge Förderanträge mussten geschrieben werden. Das kostete viel Zeit und Energie, bis sie 2017 schließlich mit dem EXIST-Gründerstipendium des Bundes erfolgreich waren. Auch die ersten Kunden zu gewinnen, war nicht leicht. „Weil wir noch keine Referenzen vorweisen konnten“, erklärt Benson. Um das berühmte „Henne-Ei-Problem“ zu lösen, entwickeln die Gründer anfangs Enzyme zum Selbstkostenpreis und verlangen nur im Falle des Erfolges eine Prämie.
Heute steht das Unternehmen nach dem Auslaufen des Stipendiums finanziell auf eigenen Füßen. „Wir sind froh, dass wir keine Anträge mehr schreiben müssen“, lacht Benson. Der letzte Abnabelungsprozess von der Universität und der TTI wird mit eigenen Räumlichkeiten und Laboren voraussichtlich im Laufe des Jahres 2019 abgeschlossen sein.
Mit ihrer Idee sind die Gründer auf eine Marktlücke gestoßen, denn vor allem kleinere und mittlere Unternehmen können sich eine eigene Entwicklungsabteilung für Enzyme nicht leisten. Zukünftig will das Gründer-Trio nicht nur als Dienstleister vorhandene Enzyme optimieren, sondern komplett neue Enzyme entwickeln. Es gebe tausende potenzielle Anwendungen für Enzyme in der industriellen Biotechnologie, von denen viele noch nicht kommerziell erschlossen sind. „Es ist das Pionierland der Biotechnologie“, sagt Benson.